Dans le cadre des essais cliniques, l’information des personnes est primordiale.
Cette information est validée par un comité de protection des personnes.
L’investigateur doit donner à la personne à qui il propose un essai clinique une information claire et précise sur de nombreux éléments :
Comme lors de tout traitement, des effets secondaires peuvent survenir.
Ces effets secondaires peuvent être prévisibles ou imprévisibles. Vous devez en informer l’investigateur qui devra les déclarer au promoteur afin qu’ils soient évalués et que des mesures de sécurité soient prises si nécessaire.
Toute question est bonne à poser.
Les essais cliniques peuvent se dérouler dans un établissement hospitalier public ou privé, dans des centres ou des maisons de santé, dans un cabinet médical, ou, parfois, au domicile des participants.
La réglementation en vigueur précise que les essais cliniques « ne peuvent être réalisés que dans un lieu disposant des moyens humains, matériels et techniques adaptés à la recherche et compatibles avec les impératifs de sécurité des personnes … ». Les lieux habituels de soins, comme les établissements hospitaliers, les cabinets médicaux, les maisons et centres de santé sont tout à fait adaptés à la conduite d’essais cliniques.
Pour certaines catégories d’essais, notamment les essais comportant une première administration d’un médicament à l’homme et les essais qui se dérouleraient ailleurs que dans un lieu de soins habituels, le lieu devra être autorisé par les agences régionales de santé.
Certains essais cliniques peuvent être menés au domicile du participant si les conditions exigées par la règlementation sont réunies et si ces conditions sont représentatives de l’utilisation « en vie réelle » du produit (par exemple un essai clinique portant sur un matelas anti-escarres installé à domicile ou un dispositif utilisé dans le traitement d’une plaie utilisé dans le cadre d’une prise en charge à domicile du patient).
L’adéquation du lieu où se déroule l’essai clinique est évaluée par le comité de protection des personnes qui donne son avis sur l’essai.
La meilleure solution est de vous adresser en premier lieu à votre médecin traitant, il vous connaît et saura vous orienter.
Il ne faut pas non plus hésiter à en parler à votre entourage.
L’idéal est de vous adresser à votre médecin traitant ou à l’équipe médicale qui vous suit déjà.
Parfois, des informations sur des possibilités de recrutement de patients ou de volontaires sains sont publiées dans des journaux locaux, affichées dans les salles d’attente des hôpitaux ou des cabinets médicaux, ou diffusées sur des réseaux sociaux.
Pour en savoir plus sur les essais cliniques en cours, vous pouvez consulter les registres qui sont disponibles sur internet.
Le premier registre à consulter pour chercher des essais cliniques sur des médicaments est le registre européen : euclinicaltrials.eu
Ce registre comporte tous les essais cliniques autorisés depuis le 1er janvier 2022.
Une carte interactive est disponible et vous permet de chercher des essais cliniques près de chez vous en fonction de l’aire thérapeutique que vous souhaitez.
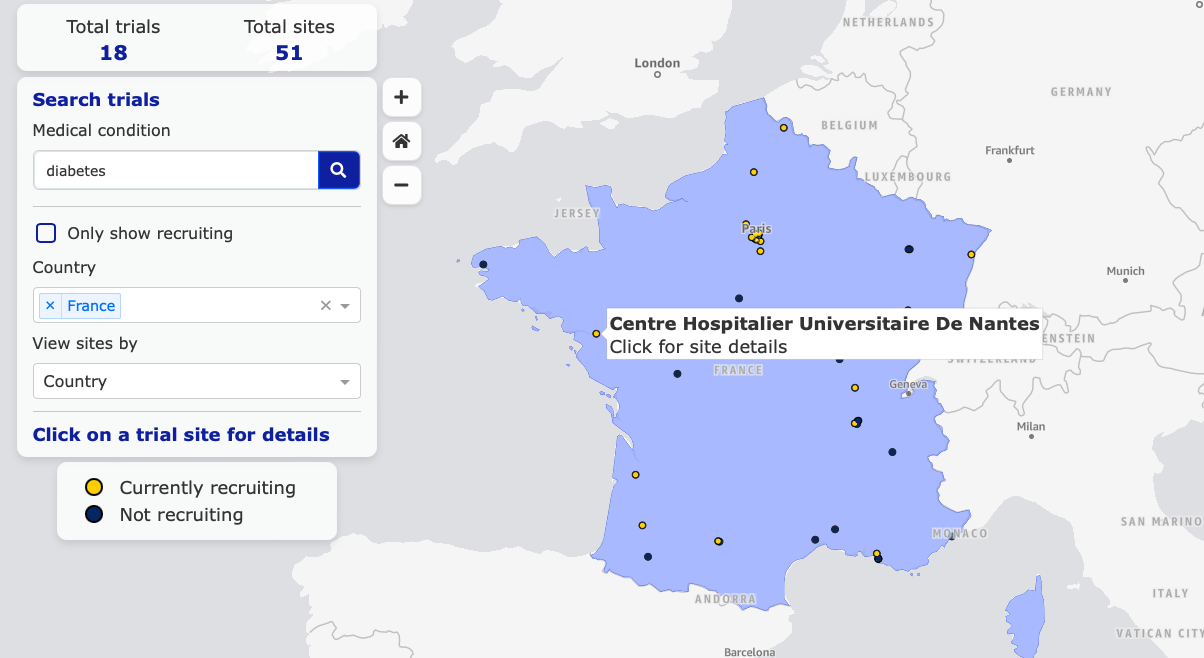
Pour y accéder : https://euclinicaltrials.eu/search-for-clinical-trials/?lang=fr
N’hésitez pas à vous faire aider d’un professionnel de santé si vous avez de difficultés pour sélectionner des recherches.
D’autres registres généraux sont encore disponibles et peuvent être consultés si besoin, comme :
– L’ancien registre européen de tous les essais cliniques de médicaments et dispositifs médicaux (en anglais) menés dans les états membres de l’Union européenne, notamment pour les essais cliniques autorisés avant le 31 janvier 2022 : www.clinicaltrialsregister.eu
Ce registre comporte aussi les résultats des essais cliniques menés en Europe avant la mise en place de la nouvelle base de données présentée ci-dessus.
– Le registre de l’institut national de santé américain (NIH) (en anglais), qui comprend des essais de toutes spécialités confondues, menés dans le monde entier : www.clinicaltrials.gov
Un mode opératoire détaillé est disponible sur notre site pour utiliser ces deux derniers registres.
Les sites internet des associations de patients, les sites internet des centres hospitaliers universitaires (CHU), les sites internet des promoteurs industriels présentent également des études ouvertes au recrutement.
Les informations trouvées sur internet ne sont pas toujours suffisamment précises pour avoir une information objective sur les essais cliniques, le mieux est de consulter les sites de référence ci-dessus et d’en parler à un professionnel de santé comme votre médecin traitant.
Les registres vous donneront des indications sur l’essai et sur les lieux où il se déroule.
Exemple du registre ClinicalTrials.gov ou du EU Clinical Trials Register.
Pour chercher un essai clinique sur une pathologie spécifique et qui se déroule en France, il suffit de taper sur la page d’accueil le nom de la pathologie en anglais (par exemple cancer) et « France » puis « Search » (chercher).
La liste de tous les essais cliniques dans cette pathologie va s’afficher.
Quelques termes importants :
Pour la lecture de ces registres, il ne faut pas hésiter à solliciter les professionnels de santé, (votre médecin traitant par exemple) qui ont l’habitude des termes utilisés et pourront vous guider facilement.
Les modes opératoires ci-dessous expliqués en français vous aideront à naviguer dans les deux principaux registres rédigés en anglais :
– EU Clinical Trials Register : registre européen des essais cliniques.
– ClinicalTrials.gov : registre du département de santé publique américain.
Avant de donner votre consentement pour participer à un essai clinique, vous devez avoir compris les explications données par l’investigateur.
N’hésitez pas à poser des questions.
La note d’information qui vous est remise doit reprendre toutes les informations données par l’investigateur, elle doit décrire les modalités du traitement, les bénéfices attendus, les risques encourus, le déroulement de l’essai afin que vous sachiez comment il va se dérouler. Vous pouvez vous y référer à n’importe quel moment, dès que vous avez une interrogation.
Si vous ne comprenez pas certaines phrases, demandez des explications à l’investigateur ou à son équipe.
Une bonne compréhension de la note d’information est essentielle avant de décider de participer à l’essai.
Si on vous propose de participer à un essai clinique, c’est pour améliorer la prise en charge de la pathologie dont vous êtes atteint.
Participer à un essai clinique permet d’avoir accès à un traitement innovant (médicament, dispositif médical, nouvelle stratégie thérapeutique…) de façon précoce. Cela permet aussi de bénéficier d’un suivi par l’équipe médicale plus important et régulier, avec des consultations et des examens supplémentaires par rapport au traitement habituel de la pathologie, mais cela ajoute des contraintes pour le patient.
Que vous soyez suivi dans le cadre d’un essai clinique ou non, votre état de santé peut à tout moment nécessiter une adaptation ou un changement de traitement. Ce changement ou cette adaptation peut être justifié par l’apparition d’un autre problème de santé ou par l’apparition d’effets secondaires liés à l’essai.
Dans tous les cas, l’investigateur s’engage à poser le meilleur diagnostic pour le meilleur traitement adapté à chaque cas. L’essai clinique ne le décharge pas de ses responsabilités.
Toute une équipe va intervenir.
Lors du déroulement de l’essai, vous serez amené à rencontrer l’investigateur, éventuellement d’autres professionnels de santé impliqués dans la conduite de l’essai : des médecins, des infirmières, des techniciens d’études cliniques, des radiologues, des biologistes, un pharmacien….
Tous ces intervenants sont formés à la réalisation des essais cliniques et feront tout pour que votre participation se déroule au mieux.
Les frais médicaux liés à la participation à un essai clinique sont intégralement pris en charge par le promoteur.
La participation à un essai ne coûte rien.
Un placebo est un produit qui a la même apparence que celle du produit que l’on évalue, mais qui ne contient pas de substance active.
Dans certains essais portant sur de nouveaux médicaments, lorsqu’il n’existe pas de traitement de référence, le nouveau médicament est comparé à un placebo. Cette comparaison permet d’être sûr de l’effet du médicament évalué. Si pendant le déroulement de l’essai, l’état de santé du participant le nécessite, qu’il reçoive un placebo ou le médicament évalué, le médecin investigateur lui prescrira d’autres traitements.
L’investigateur peut décider à tout moment d’interrompre votre participation à un essai clinique si votre état de santé le nécessite.
Dans ce cas, l’investigateur vous apportera tous les soins adaptés à votre pathologie et vous orientera vers les alternatives thérapeutiques.
Vous pouvez également mettre fin à votre participation à tout moment sans avoir à vous justifier. L’investigateur vous apportera tous les soins habituels.
Le promoteur peut également mettre fin à l’essai pour plusieurs raisons : résultats intermédiaires de l’essai non concluants sur l’efficacité, survenue d’effets indésirables. Dans le cas, l’investigateur continuera à vous apporter tous les soins habituels.
Après la finalisation de l’essai et après analyse de l’ensemble des données, il peut arriver que les résultats obtenus soient négatifs. Dans ce cas, le développement du médicament ou du dispositif médical peut être suspendu, voire stoppé.
Les frais éventuels engagés (par exemple les frais de transport, de restauration ou de stationnement) sont remboursés en totalité sur justificatif par le promoteur.
Dans certains cas, comme par exemple des essais sur des personnes non malades, des essais nécessitant une immobilisation ou un temps de présence très long, le patient peut être indemnisé en compensation des contraintes subies. Cette indemnisation est limitée par un texte officiel à 6000 euros par période de 12 mois consécutifs.
Sous réserve de l’acceptation par le comité de protection des personnes, le versement des indemnités aux volontaires sains peut être effectué par des avantages en nature, lorsque deux conditions sont remplies :
– le promoteur a fait une évaluation financière de ces avantages en nature et vérifié que le montant fixé (6000 euros par période de 12 mois consécutifs) n’est pas dépassé ;
– le promoteur a justifié le recours à ces avantages en nature au regard des spécificités de la recherche ou de la population visée.
🎧 Un essai clinique sur volontaire sain répond aux mêmes obligations que tout autre essai clinique. Il doit avoir reçu un avis favorable d’un Comité de Protection des Personnes (CPP) et une autorisation de l’Agence nationale de sécurité du médicament et des produits de santé (ANSM).
Ces essais sont conduits lors des phases précoces de développement des produits de santé (phase 1 pour les médicaments, avant marquage CE pour les dispositifs médicaux). Ils correspondent par exemple aux essais de premières administrations d’une molécule à l’homme ou de première utilisation d’un dispositif médical chez l’homme. Ces essais permettent de connaître le devenir du principe actif dans l’organisme, d’obtenir des informations sur sa sécurité, de définir la quantité à administrer pour obtenir une efficacité en toute sécurité.
Ces essais se font sur un petit nombre de volontaires sains et sous strict contrôle médical.
Les lieux de réalisation de ces essais disposent de tous les équipements permettant d’assurer la sécurité des volontaires. Ces lieux sont autorisés par les autorités de santé, agence régionale de santé (ARS). Ils peuvent être intégrés à un hôpital (centre d’investigation clinique) ou non (structures privées).
Pour en savoir plus, écouter le podcast du Dr. Claire Thalamas
Dans les recherches cliniques, il est souvent nécessaire de prélever plus d’éléments biologiques que dans les soins habituels (prises de sang, biopsies de tissus ou de tumeurs en cancérologie…). Ces prélèvements supplémentaires sont indispensables aux investigateurs et aux chercheurs.
En effet, ces prélèvements sont utilisés pour effectuer un diagnostic, et/ou pour s’assurer de l’efficacité et de la sécurité du traitement étudié, pour suivre l’état de santé de la personne qui participe à la recherche clinique.
En cancérologie, des prélèvements de tumeurs (biopsies) sont aussi effectués. L’analyse de ces biopsies est importante pour le diagnostic, pour évaluer le niveau de la maladie et pour mettre en place un traitement adapté spécifiquement au patient.
Ces biopsies sont répétées lors du déroulement de le recherche clinique afin de suivre l’évolution de la maladie et ainsi analyser l’efficacité du traitement étudié.
Souvent, ces différents types de prélèvements sont rassemblés avec d’autres prélèvements similaires provenant d’autres personnes et sont conservés. Tous les prélèvements sont rendus anonymes pour constituer des collections d’échantillons biologiques destinées à la recherche scientifique. L’utilisation de ces collections par des chercheurs permet de faire avancer les connaissances fondamentales sur de nombreuses maladies.
Dans tous les cas, l’investigateur doit donner une information sur les différents prélèvements biologiques qui seront effectués lors de la recherche clinique et sur leur utilisation qu’elle soit pour la recherche clinique ou pour d’éventuelles autres recherches scientifiques. La personne concernée doit donner son consentement pour ces utilisations.
Le comité de protection des personnes qui a donné un avis favorable à la recherche clinique a évalué l’intérêt des prélèvements effectués pour les besoins de cette recherche et a vérifié que l’information donnée à la personne qui y participe comportait aussi les informations nécessaires relatives à la collection d’échantillons biologiques.