Plusieurs mécanismes permettent d’assurer en permanence la protection des personnes pendant un essai clinique.
Ces mécanismes sont les suivants :
Ainsi, des mesures correctrices peuvent être prises à tout moment pour assurer la sécurité des personnes.
Chaque essai clinique est unique, avant de participer, il faut connaître autant de choses que possible sur l’essai, sur le traitement proposé.
Il faut poser des questions à l’investigateur et à son équipe, à votre entourage, à votre médecin traitant, aux associations de patients.
Sur la base de la note d’information qui vous a été remise, il est important de bien préparer les questions à poser avant de donner son consentement.
Il faut avoir compris le type de traitement étudié dans l’essai, les examens qui seront réalisés, le nombre de consultations qui seront nécessaires et leur fréquence, la durée totale de l’essai, les éventuels effets indésirables prévisibles et savoir à qui s’adresser en cas de survenue d’un problème quelconque.
Au moindre doute, à la moindre question, même pendant le déroulement de l’étude, il ne faut pas hésiter à interroger l’investigateur ou son équipe, votre médecin traitant, vos proches.
Le médecin ou le professionnel de santé qui vous oriente vers un essai clinique doit vous expliquer tout son déroulement.
En règle générale, votre pathologie est traitée par votre médecin traitant, un médecin spécialiste en ville ou à l’hôpital. Votre suivi se fait dans le cadre du soin habituel de cette pathologie.
Votre médecin peut vous orienter vers un essai clinique, notamment lorsque la pathologie échappe au soin habituel, et que votre état de santé le permet.
L’investigateur que vous allez rencontrer va être votre contact privilégié, il est en charge notamment de :
Si vous acceptez de participer, vous aurez des consultations régulières avec l’investigateur (souvent un peu plus fréquentes et un peu plus longues que dans le soin habituel), des examens complémentaires (analyses de sang, électrocardiogramme, IRM…), parfois des questionnaires à compléter. L’investigateur et son équipe recueilleront toutes les données nécessaires à l’essai dans le respect du secret médical.
A la fin de l’essai, votre prise en charge se fera dans le cadre du soin habituel de votre pathologie.
Toutes les informations recueillies resteront confidentielles car elles sont couvertes par le secret médical. Ces données seront rendues anonymes et analysées de façon globale (c’est-à-dire avec l’ensemble des données de tous les participants à l’essai) afin d’établir le résultat global de l’essai qui pourra vous être donné par l’investigateur si vous le souhaitez.
Seules les personnes qui l’acceptent peuvent participer à un essai clinique.
Pour participer à un essai clinique on peut être soit un volontaire sain, soit un patient en fonction de l’essai.
Pour un essai clinique en particulier, il est normal de retenir la population qui correspond à la forme de la pathologie à laquelle va s’adresser le médicament ou le dispositif médical.
Il y a une sélection des personnes avec des critères très précis qui permettront de répondre à la question posée dans l’essai.
Ces critères peuvent être des critères indispensables pour pouvoir inclure le patient dans l’essai (critères d’inclusion), comme par exemple la présence de la pathologie, certains paramètres biologiques, l’âge, le sexe, l’état général du patient. D’autres critères, s’ils sont présents, empêchent la participation de la personne à l’essai (critères d’exclusion), comme par exemple la coexistence d’une autre maladie grave ou la prise de certains médicaments. L’investigateur est chargé d’évaluer si le participant potentiel correspond à ces critères.
En pratique, il est possible d’inclure dans des essais cliniques des femmes, des hommes, des enfants, des personnes âgées.
Il est indispensable d’être affilié à une régime de sécurité sociale ou bénéficiaire d’un tel régime.
Inclure des femmes dans les essais cliniques est tout à fait possible, une vigilance particulière sera portée aux moyens de contraception utilisés, afin d’éviter la survenue d’une grossesse au cours de l’essai.
De même, des enfants peuvent être inclus dans des essais cliniques pédiatriques adaptés à leur âge et à leur pathologie.
Une attention particulière est portée à certaines catégories de personnes considérées par la loi comme « vulnérables » dans le cadre des essais cliniques (femmes enceintes, parturientes, mères qui allaitent, personnes privées de liberté par une décision judiciaire ou administrative, personnes faisant l’objet de soins psychiatriques, personnes admises dans un établissement sanitaire ou social à d’autres fins que la recherche, personnes majeures faisant l’objet d’une mesure de protection légale ou hors d’état d’exprimer leur consentement, patients mineurs). Ces personnes peuvent participer si l’importance du bénéfice attendu pour elles-mêmes est de nature à justifier le risque ou si ces recherches se justifient au regard du bénéfice attendu pour d’autres personnes se trouvant dans la même situation. Dans ce cas, les risques prévisibles et les contraintes de la recherche doivent présenter un caractère minimal.
Dans tous les cas, le consentement de la personne doit être recherché mais l’autorisation de participer sera signée par le représentant légal. Si la personne refuse, elle ne pourra pas participer.
🎧 La participation des femmes aux essais cliniques est tout à fait possible.
La participation des femmes dans un essai clinique peut être nécessaire en considérant les critères de :
Dans tous les cas, avant d’être mis en place, les essais cliniques doivent obtenir un avis favorable d’un Comité de protection des personnes (CPP). Le CPP est garant de la protection des personnes qui se prêtent à la recherche et évalue l’éthique de la recherche, la validité de l’information délivrée et des modalités de recueil du consentement. Ces contrôles incluent un examen des bénéfices et des risques attendus.
Pour en savoir plus, écoutez notre podcast hors série « Participation des femmes aux recherches cliniques »
Mon quotidien peut être plus ou moins affecté en fonction de l’essai.
Les contraintes sur la vie quotidienne du participant qu’impose la participation à un essai varient en fonction des essais et sont décrites dans la note d’information : elles peuvent être faibles ou très importantes, notamment lorsque des périodes d’hospitalisation sont prévues.
Ces contraintes portent notamment sur la prise du traitement, les visites médicales et les examens de suivi, ainsi que les déplacements qu’ils impliquent.
Afin de prendre votre décision, il vous faudra évaluer leur impact et vous assurer qu’elles sont compatibles avec votre vie familiale, votre vie professionnelle, vos loisirs, vos vacances, vos voyages…
Des informations claires et précises doivent être données aux participants.
L’investigateur doit donner à la personne à qui il propose un essai clinique une information claire et précise sur de nombreux éléments :
Lors d’un essai clinique, les consultations médicales sont en règle générale plus fréquentes et plus longues que les consultations habituelles.
Par rapport au soin habituel, il peut y avoir des examens médicaux, chirurgicaux, d’imagerie supplémentaires, des examens de sang plus nombreux.
Parfois, l’essai demande une hospitalisation en raison d’examens récurrents fréquents (par exemple pour établir le devenir d’un médicament dans l’organisme avec nécessité d’examens sanguins toutes les heures).
Avant de vous décider à participer, n’hésitez pas à demander de façon très précise comment se déroule une consultation et quels examens vont être pratiqués. Vous pouvez également renouveler cette demande à tout moment dès que vous avez une interrogation.
La décision de participer est importante. Quelques idées de questions à se poser.
La décision de participer est importante et ne doit pas être précipitée. Un délai de réflexion est proposé avant de donner son consentement.
Si une association de patients sur la pathologie concernée par la recherche proposée existe, il ne faut pas hésiter à la contacter.
Dans certaines associations de patients, des personnes compétentes formées sur les essais cliniques peuvent répondre à toutes vos questions et vous orienter correctement.
Par exemple, France Assos Santé * (union nationale des associations agréées d’usagers du système de santé) est une organisation de référence pour représenter les patients et les usagers du système de santé. Elle regroupe 85 associations de patients et d’usagers qui recouvrent un très grand nombre de pathologies (maladies rares, maladies chroniques, etc).
Pour en savoir plus : france-assos-sante.org
Concernant le médicament, une « Académie européenne des patients » (EUPATI) sur l’innovation thérapeutique a été mise en place. Cet organisme regroupe de nombreux partenaires publics et privés. Son rôle principal est l’éducation et la formation des patients afin d’accroître leur capacité à comprendre la recherche et le développement des médicaments et d’améliorer la diffusion auprès du public d’informations objectives.
Pour en savoir plus : eupati.eu
* France Assos Santé est partenaire de Notre Recherche Clinique
Comme toute personne qui participe à un essai clinique, le volontaire sain doit être affilié à un régime de sécurité sociale ou bénéficiaire d’un tel régime. Un examen médical préalable à toute participation doit être effectué. Il est recommandé d’en parler à son médecin traitant avant d’envisager de participer.
En fonction de l’essai, des critères d’âge, de sexe, d’habitudes de vie, etc. sont pris en compte.
Pour participer, il est possible de contacter les centres autorisés (centres d’investigations cliniques ou CIC, centres de phase 1 privés) proches de son domicile.
Parfois, des annonces peuvent être publiées dans des journaux ou être affichées dans des salles d’attente dans les hôpitaux ou les cabinets médicaux. Ces annonces ont fait l’objet d’une validation par le Comité de Protection des Personnes.
Le volontaire sain peut également rechercher des essais de phase 1 sur les répertoires disponibles.
La participation à ces essais peut être indemnisée (maximum de 6000 Euros par an).
Sous réserve de l’acceptation par le comité de protection des personnes, le versement des indemnités aux volontaires sains peut être effectué par des avantages en nature, lorsque deux conditions sont remplies :
– le promoteur a fait une évaluation financière de ces avantages en nature et vérifié que le montant fixé (6000 euros par période de 12 mois consécutifs) n’est pas dépassé ;
– le promoteur a justifié le recours à ces avantages en nature au regard des spécificités de la recherche ou de la population visée.
Le volontaire est inscrit sur un fichier national qui permet de garantir le respect d’un délai éventuellement nécessaire avant de participer à un autre essai et de contrôler le montant des indemnités reçues par une même personne.
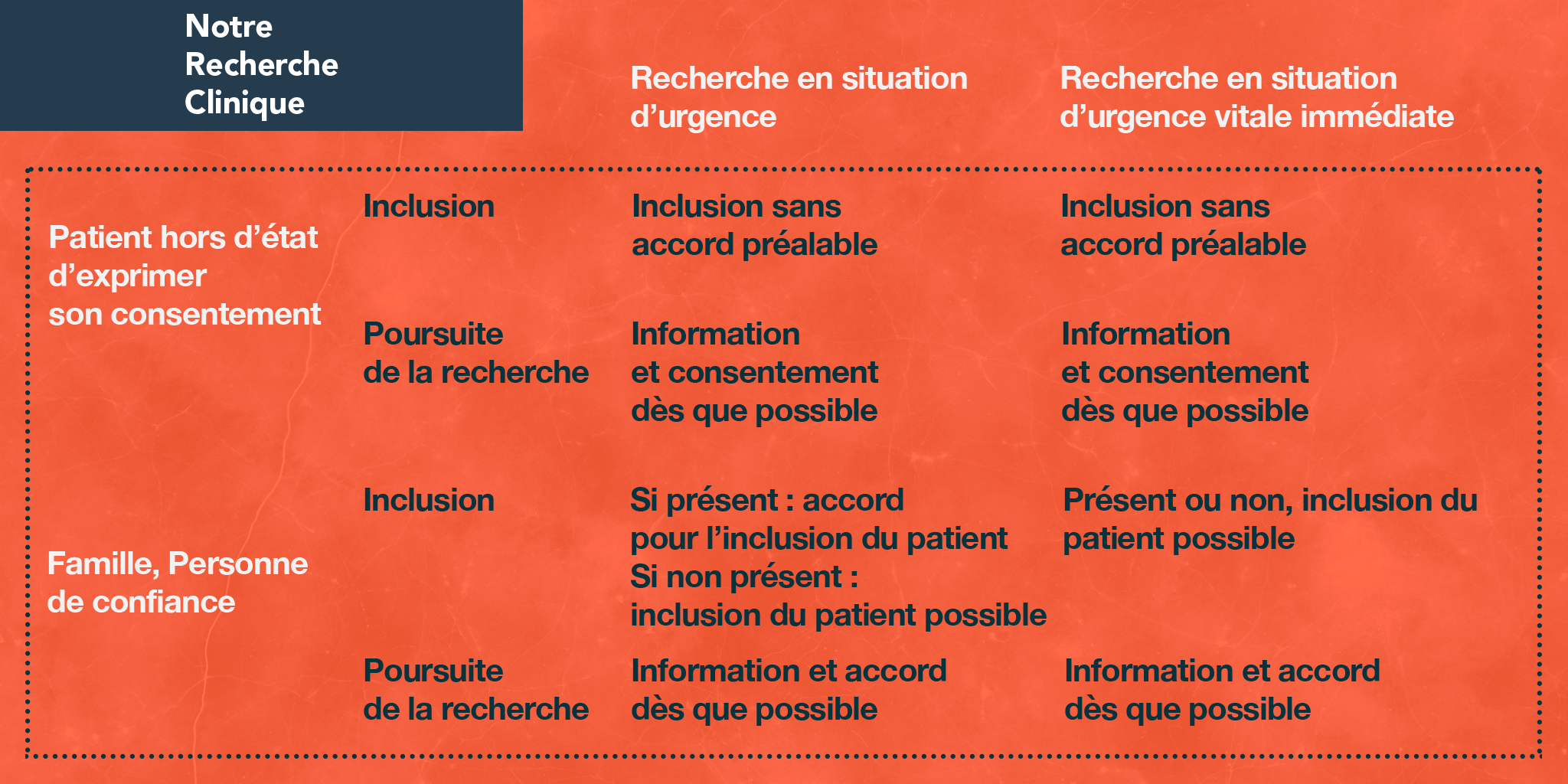
La loi a prévu la possibilité de conduire des recherches dans des situations d’urgence qui ne permettent pas de recueillir le consentement préalable de la personne (par exemple recherches en réanimation ou sur la prise en charge des urgences vitales comme un arrêt cardiaque, une détresse respiratoire aiguë…) afin de permettre l’évolution des soins apportés.
Pour ces recherches, le protocole de l’essai prévoit l’inclusion des patients en urgence si elle est nécessaire.
Dans tous les cas, le Comité de Protection des Personnes a évalué cette possibilité et a donné un avis favorable à la conduite de la recherche. Le principe est de solliciter le consentement des membres de la famille ou de la personne de confiance s’ils sont présents. En cas d’urgence vitale immédiate, une dérogation à ce principe est possible, dans ce cas, le consentement du patient, de la famille ou de la personne de confiance sera demandé dès que possible pour la poursuite de la recherche. Ils peuvent s’y opposer et peuvent également s’opposer à l’utilisation des données recueillies.
Quand la participation d’un patient à un essai se termine, l’équipe médicale qui le suit continue sa prise en charge dans le cadre du soin habituel de sa pathologie.
La dernière consultation réalisée par l’investigateur dans le cadre de l’essai clinique assure le retour aux soins et aux traitements habituels de la pathologie de la personne qui a participé à l’essai. Le médecin proposera au patient le meilleur traitement disponible.
Il peut y avoir quelques exceptions, par exemple :